15838214737
ISO13485医疗器械管理体系认证的准备材料和注意事项
近来几年申请ISO体系认证的企业越来越多,于是有的没有申请过ISO体系认证的企业也有兴趣想要申请ISO体系认证,其中有的企业很想要申请ISO13485医疗器械管理体系认证,但对ISO13485医疗器械管理体系认证的了解较少,因此想要了解ISO13485医疗器械管理体系认证的准备材料和注意事项,感兴趣的话就跟小编一起去看看吧。

申请医疗器械质量认证应向认证机构报送以下材料:
申请方授权代表签署的产品质量认证申请书、质量体系认证申请书;
申请单位营业执照或注册证明文件(复印件);
申请单位质量手册,必要时提供企业的程序文件;
申请认证的产品或质量体系覆盖的产品标准;
申请方声明执行的标准;
医疗器械产品注册证(复印件);
产品生产全过程情况总结,产品生产流程及特殊过程、关键过程说明;
近三年产品销售情况及用户反馈信息;ISO13485主要外购、外协件清单;
其他材料,如企业产品目录、产品简介、产品宣传材料等;为其提供过认证咨询的组织和人员的信息。
医疗器械ISO13485:2016医疗器械管理体系的十个基本注意事项:
1、ISO13485:2016建立于ISO9001:2015的过程模式之上。
2、ISO13485:2016依据符合各类全球法规的质量体系要求的模式建立。
3、由于重点的改变成法规要求模式,13485:2016的编写者将ISO9001:2015中强调客户满意度的部分删除。
4、ISO13485并未被FDA采纳,FDA仍将继续坚持其独立的质量体系法规(QSR)。但是,FDA参与编写ISO13485:2016的人员确信他们的标准和13485:2016可以并行。因此,一家符合ISO13485:2016要求的公司也很容易达到FDAQSR的要求。
5、TR14969是使用和执行ISO13485:2016的指南。
6、13485:2016并非依照商业推进模式而是依照作为保持过程有效性的工具模式而建立。
7、与ISO9001:2000不同,ISO13485:2016不允许制造厂商合理的裁减文件。为了确保公司符合规则要求,ISO13485:2016得更具说明性并要求某些过程文件仍需建立。
8、风险管理也是ISO13485:2016中一个非常关键的因素。
9、在ISO13485:2016和ISO9004:2015(质量管理体系基础标准)之间没有重大联系。
10、ISO13485:2016和其他“非质量”管理体系如ISO14001和ISO45001相兼容.
 相关推荐
相关推荐
 热门阅读
热门阅读-
什么是FEMA(潜在失效模式与后果分析)
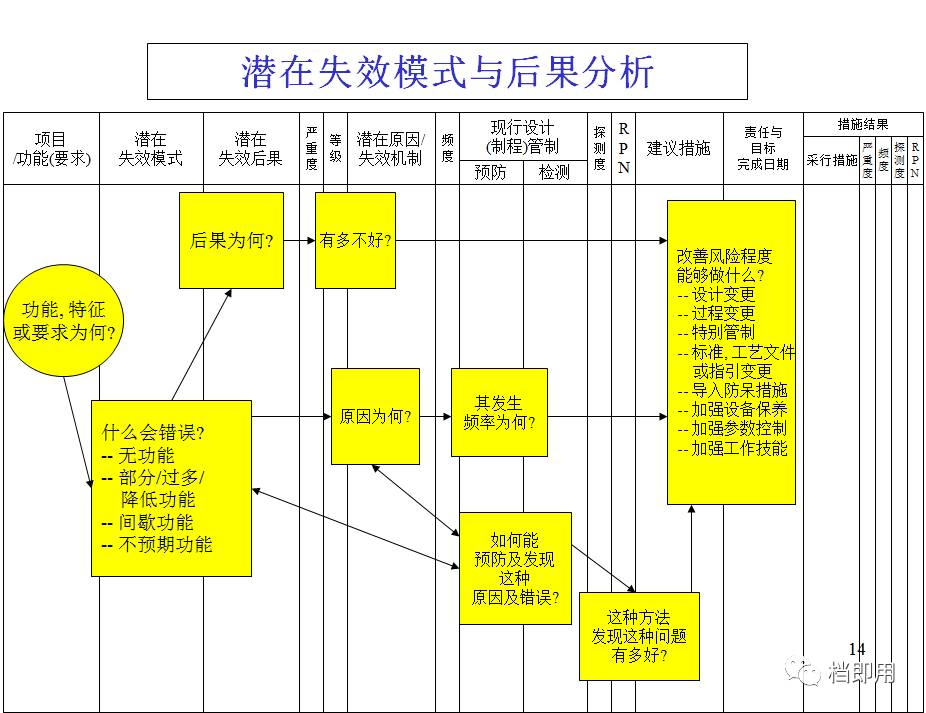
FMEA是失效模式与影响分析的缩写,因其英文名称时Failure Mode and Effects Analysis,所以简写为FMEA,也就是潜在失效模式与后果分析,FME
-
三体系认证每年都要审核么

三体认证的有效期为三年,并且每年都要进行监督审核。ISO三体系认证三年需要审核三次,首次初审,其余两次是监审,也就是监督
-
DAkkS是什么意思?DAkkS的职责是什么

DAKKS是什么?DAkks德国认可委员会认可的实验室资质,它相当于德国的认监委,在大约4300个认证程序中,DAkkS作为一个独立机构,评估和
-
职业危害因素的来源分为哪几种?

物理因素 主要为异常气象条件如高温、高湿、低温等;异常气压如高气压、低气压等;噪声及振动;非电离辐射如可见光、紫外线、红外
-
粉尘爆炸有哪五个条件?

粉尘爆炸的五个条件 一、空气(氧气); 二、浓度超过MEC的可燃性干粉尘; 三、点火源; 四、空间受限或封闭; 五、分成悬浮、分散(与氧
 最新文章
最新文章-
 认证知识 2023-04-18
认证知识 2023-04-18 -
 认证知识 2023-04-18
认证知识 2023-04-18 -
 认证知识 2023-04-18
认证知识 2023-04-18 -
 认证知识 2023-04-18
认证知识 2023-04-18 -
 认证知识 2023-04-18
认证知识 2023-04-18
